GRUPOS DE LA TABLA PERIODICA
Introducción
En el siguiente informe se presentaran las descripciones y características de los grupos IV, V, VI, VII A de la tabla periódica; de igual manera se hablara de cada elemento perteneciente a los grupos anteriormente nombrados. Se sabe que la tabla periódica es un esquema de todos los elementos químicos dispuestos por orden de numero atómico creciente y en una forma que refleja la estructura de los elementos; los elementos están ordenados en 7 hileras horizontales, llamadas periodos, y en 18 columnas verticales, llamadas grupos.
Objetivos
Objetivo General:
- Dar a conocer las propiedades de los grupos IV, V, VI, VII A de la tabla periódica, al igual que de los elementos que los componen
Objetivos Específicos
- Conocer mas específicamente la tabla periódica de los elementos químicos
- Identificar los diferentes elementos que componen los grupos IV, V, VI, VII A de la tabla periódica
- Caracterizar los grupos IV, V, VI, VII A de la tabla periódica
Marco Teórico
Tabla Periódica
Es una disposición de los elementos químicos en forma de tabla, ordenados por su numero atómico (numero de protones), por su configuración de electrones y sus propiedades químicas. Este ordenamiento muestra tendencias periódicas, como elementos con comportamiento similar en la misma columna.
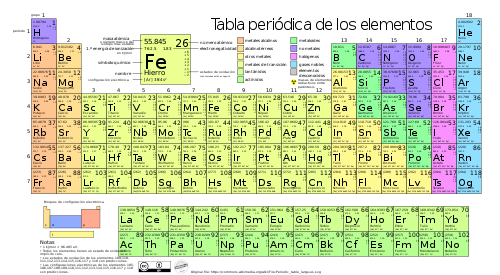
El procedimiento para clasificar los elementos colocandolos por orden de su numero atómico y el comportamiento químico de los elementos llevo a dividirla en:
- 7 renglones horizontales llamados "periodos", que corresponde a cada una de las 7 capas o niveles de energía: K, L, M, N, O, P, Q.
- El numero de columnas verticales se denomina "grupos": I, II, III, IV, V, VI, VII y VIII, y para que los elementos de propiedades semejantes se encuentren unos debajo de otros, cada uno de los grupos ha sido divido en 2 subgrupos, a los que se les designa con la letra A y B. Por ultimo esta el "grupo O" o gases nobles, que tienen en común denominador la ultima capa orbital llena.
Grupo IV A
Llamado familia del carbono, los primeros son dos no metales (carbono y silicio), y los tres últimos son metales (germanio, estaño y plomo) y sus valencias mas comunes son +2 y +4.
Estos elementos conforman mas de la cuarta parte de la corteza terrestre y solo podemos encontrar en su forma natural al carbono, al estaño y al plomo.
Estos elementos no suelen reaccionar con el agua, los ácidos reaccionan con el germanio, estaño y plomo, las bases fuertes atacan a los elementos de este grupo, con la excepción del carbono, desprendiendo hidrógeno, reaccionando con el oxigeno formando óxidos.
1.Carbono: Es un elemento que posee formas atropicas. Presenta una gran afinidad para enlazarse químicamente con otros átomos pequeños, incluyendo otros átomos de carbono con los que puede formar largas cadenas, y su pequeño radio atómico le permita formar enlaces múltiples.
2.Silicio: Se presenta en forma amorfa y cristalizada; aunque es un elemento relativamente inerte y resistente la acción de la mayoría de los ácidos, reacciona con los halogenos.

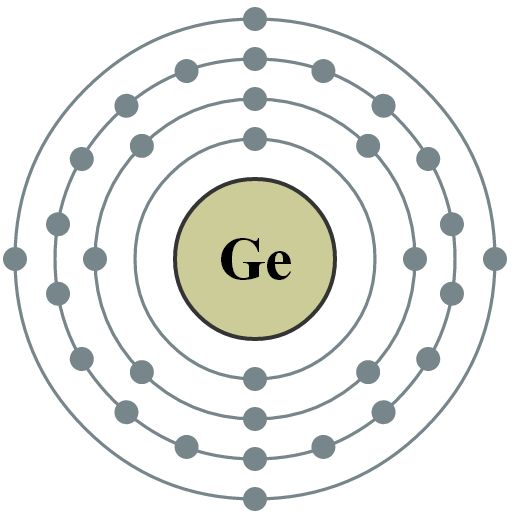
3.Germanio: Tiene una apariencia metálica, pero exhibe las propiedades físicas y químicas de un metal solo en condiciones especiales. Forma un gran numero de organometalicos y es un importante material semiconductor utilizado en transistores y fotodectectores.



Grupo V A
También denominado familia del nitrógeno; de los elementos que lo componen el nitrógeno y el fósforo son no metales, por otro lado el arsénico, antimonio y bismuto son metales. Su numero de valencia mas común es +1, +3, +5, -1 y -3. Sus componentes poseen 5 electrones de valencia, por lo tanto, tienden a formar enlaces covalentes, y en ocasiones algunos forman enlaces iónicos. A alta temperatura son muy reactivos y suelen formarse enlaces covalentes entre el nitrógeno y el fósforo, y enlaces iónicos entre el arsénico y el bismuto y otros elementos. El nitrógeno reacciona con O2 y H2 a altas temperaturas.
1. Nitrógeno: El estado del nitrógeno en su forma natural es gaseoso. El nitrógeno molecular es el principal constituyente de la atmósfera. Es constituyente de todas las proteínas, ya sean vegetales o animales, así como también de muchos materiales orgánicos. Su principal fuente mineral es el nitrato de sodio.

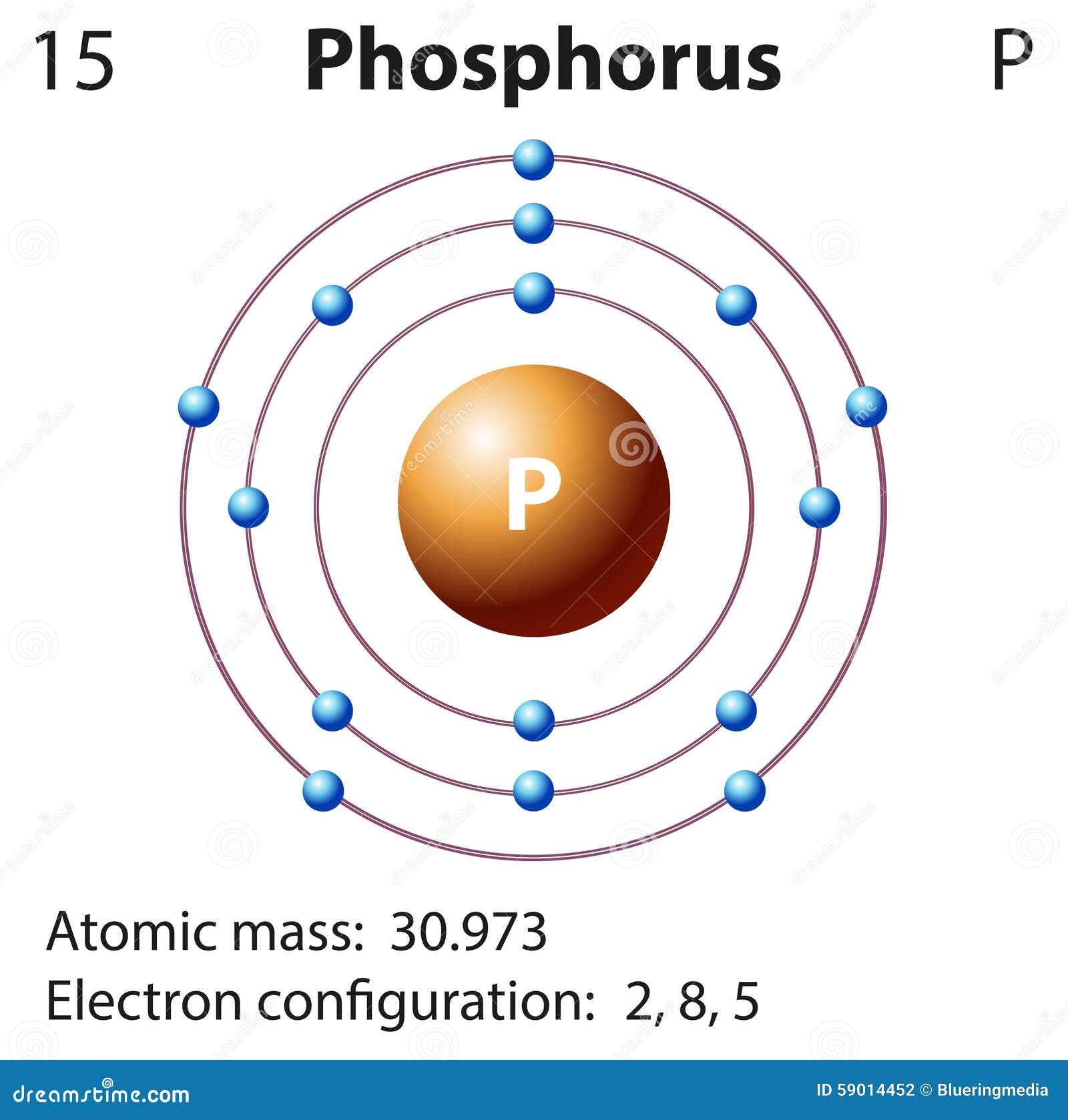
2. Fósforo: El estado del fósforo en su forma natural es solido. El fósforo es un elemento de aspecto incoloro, rojo, blanco o negro y pertenece al grupo de los no metales. El fósforo no se encuentra libre en la naturaleza. Sin embargo, sus compuestos abundan y están distribuidos ampliamente; se encuentran en muchos yacimientos de roca y minerales.
3. Arsénico: El estado del arsénico en su forma natural es solido. Es un elemento químico de aspecto gris metálico. Se hace uso de este en aleaciones no ferrosas para aumentar la dureza de las aleaciones de plomo facilitando la fabricación de perdigones, entre otras.

4. Antimonio: El estado del antimonio en su forma natural es solido. Es un elemento químico de aspecto gris plateado y pertenece al grupo de los metaloides. El antimonio es un elemento abundante en la naturaleza, muy rara vez se encuentra en forma natural y con frecuencia se encuentra como una mezcla isomorfa con arsénico.

5. Bismuto: El estado del bismuto en su forma natural es solido. Es un elemento químico de aspecto rojo, blanco brillante y pertenece al grupo de los metales. Es uno de los pocos metales que se dilatan en su solidificación, también es el mas diamagnetico de todos los metales y su conductividad térmica es menor que la de otros metales. Se oxida ligeramente cuando esta húmedo y es inerte al aire seco a temperatura ambiente, cuando supera su punto de fusión se forma rápidamente una película de oxido.

Grupo VI A
También llamada familia del oxigeno; los elementos que pertenecen a este grupo son oxigeno, azufre, telurio y polonio, todos de carácter no metal; su numero de valencia mas común es -2, +2, +4 y +6. Los elementos de este grupo muestran una transición paulatina desde las propiedades tipicamente covalentes en la parte alta del grupo hasta las tipicamente metálicas del elemento mas pesado; constituyen un excelente ejemplo de como los modelos de enlace covalente y metálico son, únicamente, casos extremos imaginarios de una situación real mas compleja de interpretar. Este aumento se pone de manifiesto no solo en la variación progresiva de sus propiedades físicas y químicas sino también en cambios en sus estructuras.
1. Oxigeno: Es el elemento mas abundante en el planeta tierra. Existe en estado libre como O2, en la atmósfera, pero también combinado en el agua y formando parte de diversos óxidos y oxosales, como silicatos, carbonatos, etc. A diferencia del oxigeno, que se presenta en su variedad mas estable como molécula diatomica O2 derivada de un enlace doble, los demás presentan estructuras derivadas de enlaces sencillos. Esto es debido a la disminución de la eficacia del solapamiento lateral a medida que aumenta el tamaño de el.

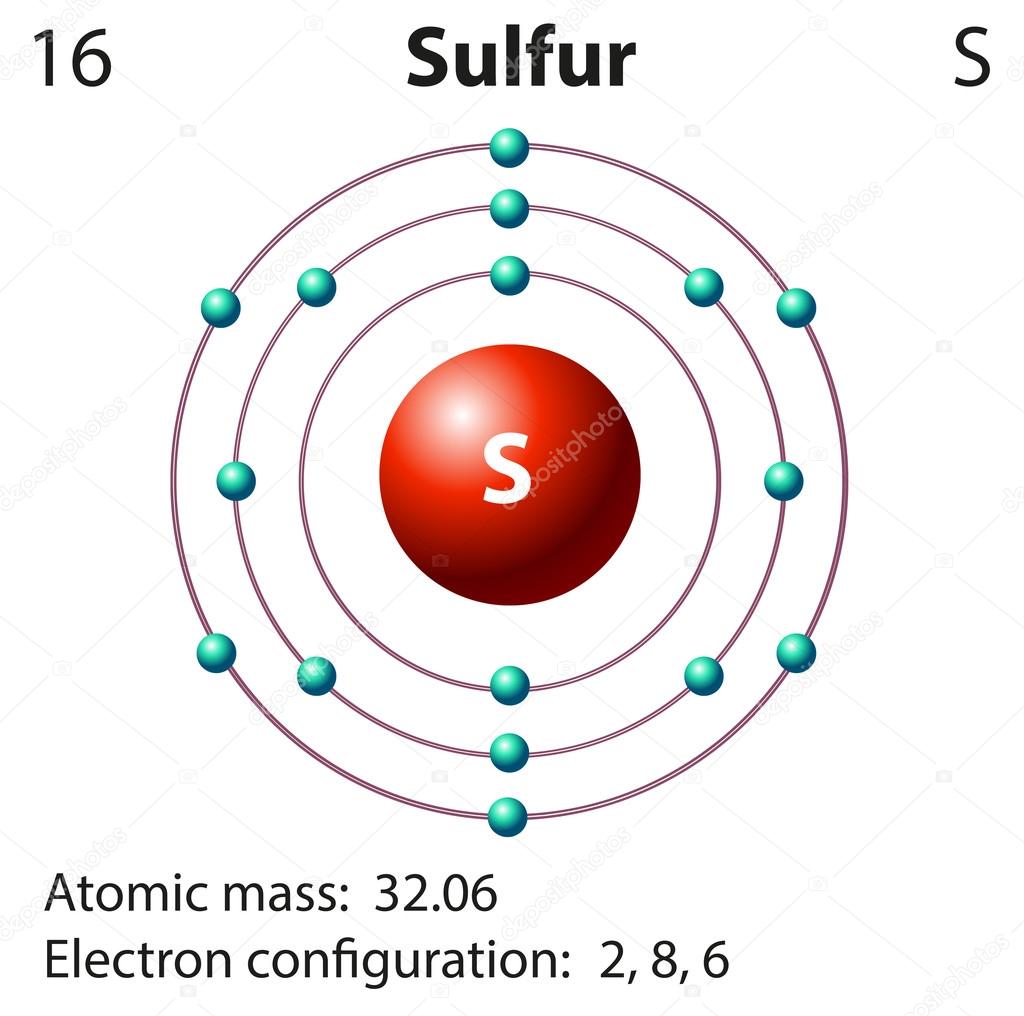
2. Azufre: Este no metal tiene un color amarillento fuerte, amarronado o anaranjado y arde con llama de color azul, dependiendo dióxido de azufre. Es insoluble en agua, pero se disuelve en disulfuro de carbono. Es un elemento multivalente.
3. Telurio: Este tipo de elementos tienen propiedades intermedias entre metales y no metales, es decir, metaloides. Es utilizado especialmente en el sector de la industria electrónica, ya que se trata de un elemento con grandes propiedades para la conductividad.

4. Polonio: El polonio forma parte de los elementos denominados metaloides o semimetales; en cuanto a su conductividad eléctrica, este tipo de materiales al que pertenece el polonio, son semiconductores. Presenta dos alotropos: Cubico simple y romboedrico, en los que cada átomo esta directamente rodeado por seis vecinos a distancias iguales.

Grupo VII A
También denominado familia de los alogenos; sus integrantes son flúor, cloro, bromo, yodo y astato, los cuales son no metales y sus numero de valencia mas comunes son -1, +1, +3, +5, +7. Son elementos muy reactivos, nunca se encuentran libres en la naturaleza. Tienen siete electrones de valencia y una fuerte tendencia a ganar un electrón; tiene las energías de ionización mas elevadas y en consecuencia son los elementos mas electromagnéticos; reaccionan fácilmente con los metales formando sales, todos son gaseosos a temperatura ambiente menos el bromo que es liquido en condiciones ambientales normales. Se característica mas fundamental es su capacidad oxidante por que arrebatan electrones de carga y moléculas negativas a otros elementos para formar aniones.
1. Flúor: Es el elemento químico de numero 9 y su símbolo es F; es un gas a temperatura ambiente de color amarillo, formados por moléculas diatónicas F2. Es el mas electronegativo y reactivo de los elementos. En forma pura es altamente peligroso, causando graves quemaduras químicas en contacto con la piel. Sus derivados tienen mucho uso industrial.

2. Cloro: Elemento químico de numero 17, su símbolo es Cl; en condiciones normales y estado puro forma dicloro: un gas toxico amarillo-verdoso formado por moléculas diatomicas, de olor desagradable y toxico. Es un elemento abundante en la naturales y se trata de un elemento químico esencial para muchas formas de vida. Reacciona con rapidez con muchos elementos y compuestos químicos.

3. Bromo: Es corrosivo, resulta peligroso para la salud y debe manipularse con sumo cuidado. A temperatura ambiente, el bromo se evapora con gran facilidad y ese vapor se caracteriza por un intenso olor fétido y de color rojo que resulta muy irritante para la garganta y los ojos. Si este elemento entra en contacto con la piel, puede provocar dolorosas heridas.

4. Yodo: Este elemento puede encontrarse en forma molecular como yodo diatomico; es un elemento bastante particular, de un color negro azulado y brillante, es un elemento no metálico y el de menor reactividad entre los de su tipo. En estado natural, solido, el yodo puede encontrarse en yoduros oceánicos y otras formaciones acuosas como piscinas de salmuera, siendo las algas marinas la principal fuente natural de yodo en el planeta.

5. Astato: Su símbolo es At y su numero atómico es 85; es radioactivo y el mas pesado de los halogenos. Se produce a partir de la degradación de uranio y torio. Realmente se trata de un elemento muy, pero muy curioso, siendo ampliamente considerado como el elemento químico mas raro del mundo. Se piensa que el astato es mas metálico que el yodo. Tiende a tener una apariencia oscura, lustrosa y brillante.
Conclusión
Para concluir podemos decir que un elemento químico es un tipo de materia, constituida por átomos de la misma clase, con un numero determinado de protones en su núcleo, haciéndolo pertenecer a una categoría única clasificada con el numero atómico, aun cuando este puede desplegar distintas masas atómicas; los elementos químico tratados en el anterior trabajo contituian un grupo especifico en la tabla periódica, cada uno clasificado según sus características, las cuales, como vimos pueden variar demasiado de un grupo a otro, pero siempre habiéndose una constante en un determinado grupo. Todos estos elementos se encuentran situados estrategicamente en la tabla periódica, la cual no es mas que un esquema que nos presenta de forma ordenada a los distintos elementos químicos; las propiedades físicas y químicas de los elementos tiende a repetirse sistemáticamente conforme aumenta el numero atómico. Todos los elementos de un grupo presentan una gran semejanza y, por lo general, difieren de los elementos de los demás grupos.
Material de Apoyo
Webgrafia
- https://bibliotecadeinvestigaciones.wordpress.com/quimica/tabla-periodica-de-los-elementos-quimicos/
- https://es.slideshare.net/JaritzaGutierrezRome/grupos-viiviviv-a
- https://es.wikipedia.org/wiki/Elemento_qu%C3%ADmico
- https://es.wikiquote.org/wiki/Elemento_qu%C3%ADmico
- https://es.wikipedia.org/wiki/%C3%81stato
- https://es.wikipedia.org/wiki/Yodo
- https://es.wikipedia.org/wiki/Cloro
- https://es.wikipedia.org/wiki/Tabla_peri%C3%B3dica_de_los_elementos
- http://enciclopedia.us.es/index.php/Grupo_de_la_tabla_peri%C3%B3dica
- https://www.deperu.com/abc/quimica/6117/grupos-de-elementos-de-la-tabla-periodica
- https://youtu.be/-2ymBr8LYSs
- https://youtu.be/JJJBqiZy-Hs
- https://youtu.be/b4LFolL4QxM
- https://youtu.be/SDzZca5r1ds
- https://youtu.be/71R8-86tGxM
- https://youtu.be/GWA7rueNlVM
Comentarios
Publicar un comentario